위산과다, 속쓰림, 위·십이지장궤양, 역류성식도염 등에 널리 처방 사용되는 있는 '잔탁' 의약품에 발암물질이 함유되었다는 소식에 보건당국이 긴급 안전점검에 나서 국내 유통제품에선 일단 발암물질이 검출되지 않았다고 밝혔다.
이에앞서 미국FDA·유럽의약품청·캐나다의약품청은 발암물질 함유 의심 잔탁(라니티틴제제)를 처방받은 환자들에게 "복용을 중지하지는 말라고 권고하고, 처방을 변경하고자 하는 경우는 전문가와 상담하고, 일반의약품으로서 라니티딘을 복용 중인 환자는 시중에 많이 있는 동일 효능의 다른 제품들을 사용할 것"을 권고하는 형식의 의약품 안전정보를 발령했다.
이에따라 식품의약품안전처(처장 이의경)는 잔탁(Zantac) 제품과 잔탁에 사용하는 원료제조소에서 생산된 라니티딘에 대해 긴급 검사을 실시하고 " ‘N-니트로소디메틸아민(NDMA.WHO 국제 암연구소(IARC) 2A 물질(인간에게 발암물질로 작용할 가능성 있는 물질 )이 검출되지 않았다"는 내용을 담은 검사결과를 16일 오후 발표했다.
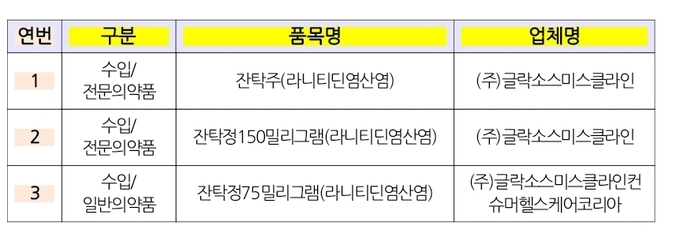
식약처는 미국FDA와 유럽의약품청(EMA)이 9월 14일(현지기준, 9월 13일) 글락소스미스클라인(GSK)의 잔탁에서 NDMA가 검출되었다는 위해정보를 입수하고, 미국 FDA가 미량 검출되었다고 발표한 라니티딘 제품중, 우선 한국 GSK가 허가 받은 잔탁 3개품목( 잔탁정 75mg(일반의약품), 잔탁정 150mg(전문의약품), 잔탁주 2mL(주사제) 29개제품(제조번호)과 잔탁에 사용된 원료 라니티딘(6개), 총 35개를 긴급하게 수거·검사를 실시했다.
ㅡ잔탁 3품목 현황
식약처는 현재 수입 또는 국내 제조되는 모든 라니티딘 원료와 해당 원료를 사용한 의약품(395품목)을 대상으로 계속해서 수거·검사를 확대 실시할 계획이다.
아울러, 식약처는 각국의 NDMA검출 정보를 공유하고 라니티딘 중 NDMA 발생원인 등을 밝히기 위해 미국 FDA와 유럽 EMA 등 각 국 규제기관과 긴밀히 협력하고 있다고 밝혔다.
ㅡ발암물질 함유 소동 잔탁은?
Q1) ‘라니티딘’이 무엇인지? ◦ 라니티딘은 위산과다, 속쓰림, 위·십이지장궤양, 역류성식도염 등에 사용하는 의약품입니다. Q2) ‘라니티딘’제제의 NDMA 검출 관련 해외정보는 언제 인지했는지? ◦ ‘라니티딘’제제의 NDMA 검출 해외정보는 ‘19.9.14.(토)에 FDA 및 EMA에서 관련 위해정보를 공개(현지시간 ‘19.9.13)함에 따라 처음 인지하게 되었습니다. Q3) ‘라니티딘’제제에서 NDMA 검출 원인은? ◦ 식약처를 포함한 미국, 유럽 각 국 규제기관들은 검출 원인이 발사르탄의 경우와 다른 것으로 추정하고 있으며, 현재 조사 중에 있습니다. Q4) 수거검사는 왜 잔탁만 했는지? ◦ 미국FDA 등 해외정보에서 잔탁에 대한 언급하고 있어, 오리지널 제품인 잔탁과 해당 주성분 원료에 대하여 우선 검사하였습니다. - 나머지 다른 제조소의 ‘라니티딘’에 대하여도 수거·검사를 확대·실시할 계획입니다 Q5) 후속 다른 제조소 제품에 대한 검사계획은 어떻게 되나요? ◦ 국내 허가·등록되어 있는 ‘라니티딘’ 원료의약품 제조소는 11개소로, 금번에 수거한 1개 제조소 이외 10개 제조소에서 생산되어 유통 중인 원료의약품에 대하여 우선 수거·검사할 계획입니다. - 그 결과에 따라, 완제의약품에 대하여도 단계적으로 검사를 실시할 계획입니다. Q6) 미국 FDA에서는 환자들로 하여금 사용 관련하여 의사상담 등 받도록 하고 있는데, 식약처의 조치는? ◦ 현재 우리 처의 수거·검사 결과, NDMA가 검출되지 않고 있으므로 회수 등 조치는 하지 않고 있습니다. - 참고로, 미국FDA·유럽의약품청·캐나다의약품청에서는 환자들에게 복용을 중지하지는 말라고 권고하고, 처방을 변경하고자 하는 경우는 전문가와 상담하고, 일반의약품으로서 라니티딘을 복용 중인 환자는 시중에 많이 있는 동일 효능의 다른 제품들을 사용할 수 있을 것임을 밝히고 있습니다. Q7) 잔탁의 국내 시장점유율은? ◦ 2018년 수입 및 생산실적 기준으로 위장병(소화성궤양) 치료제는 약 1조 511억원이며, 이 중 라니티딘 함유 의약품은 2,664억원으로 25.3%에 해당합니다. - 따라서, 라니티딘 이외 위장병 치료제의 비중은 74.7%입니다. ◦ 아울러, 라니티딘 함유 완제의약품 전체 수입·생산액은 2,664억원 중 잔탁 3품목의 수입실적은 6천180만원입니다(2018년 기준). |