(주) 한독이 국내 의약품 시장에 유통, 시판하고 있는 뇌전증 및 '간질/유아경련, 비정상적인 뇌파 패턴, 지적 장애를 특징으로 하는 증상'을 보이는 이른바 영아 연축 치료제인 ‘사브릴정500mg(비가바트린)’이 다른 원료 혼입 등 품질 문제로 판매 중단 및 회수 조치됐다.
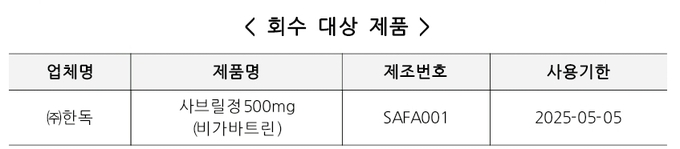
회수 대상 제품의 제조번호는 SAFA001이며,사용기한은 2025년 5월 5일 까지다.
-다른 원료 혼입으로 판매 중단 및 회수 조치 제품

식품의약품안전처(처장 오유경)는 14일 뇌전증과 영아 연축 치료제인 ‘사브릴정500mg(비가바트린)’에 사용된 주성분 ‘비가바트린’ 일부에서 다른 의약품 성분인 ‘티아프리드’가 미량 검출되었다는 해외정보에 따라 7월 14일부터 해당 원료를 사용해 제조된 1개 제조번호 제품에 대해 사전예방적 차원의 영업자 회수를 진행하고 있다고 밝혔다.
< 회수 대상 제품 >
㈜한독은 주성분 ‘비가바트린’ 일부에서 ‘티아프리드’ 성분이 검출된 원인에 대해 이탈리아 소재 주성분 제조원에서 ‘티아프리드’를 제조 후 동일한 제조설비로 ‘비가바트린’을 제조하는 과정에서 이전에 제조한 ‘티아프리드’ 성분이 제조설비에 미량 남아 이행(carryover)돼 발생한 것으로 추정하고 있다.
회수는 현재 전세계적으로 진행되고 있으며, 실제 ‘티아프리드’의 최고 검출량은 1일 노출 허용량인 200㎍/day 미만으로 부작용을 유발할 가능성은 낮을 것으로 회사측은 예상하고 있다.
-사브릴정500mg 생산 실적(단위 천원)
식약처는 ‘사브릴정500mg’이 영아에 주로 사용되는 점을 고려해 사전예방적 차원의 영업자 회수를 실시토록 하는 한편, 의‧약사와 소비자에게는 제조번호와 사용기한을 확인해 사용 시 주의를 기울여 줄 것을 당부하는 내용을 담은 ‘의약품 안전성 서한’을 배포했다.
한편 식약처는 ‘사브릴정500mg’과 관련성이 의심되는 부작용 발생 등 이상 징후가 있는 경우 한국의약품안전관리원(전화: 1644-6223, 팩스: 02-2172-6701)에 신고해 줄 것을 당부했다.
