식품의약품안전처(처장 오유경)와 대한마취통증의학회(회장 연준흠)는 내시경 검사나 수술·시술 등을 위해 마취제나 최면진정제를 투여한 당일에는 운전, 기계조작 등 집중력과 판단력이 지속적으로 필요한 일을 하지 말 것을 당부했다.

수면마취 시 프로포폴(마취제)이나 미다졸람(최면진정제) 등 의료용 마약류가 많이 사용되며, 사용한 의료용 마약류의 특성과 환자의 체질, 건강 상태에 따라 수면마취의 지속시간이 달라질 수 있다.
빨리 회복된다고 알려진 프로포폴의 경우도 정상적인 행동이 어려운 상태(수행 장애)가 12시간 지속될 수 있다.
또한 대부분 환자는 단시간 내에 깨어나지만, 의식을 회복한 뒤에도 몽롱한 상태가 장시간 지속되는 경우도 빈번하다.
연준흠 회장은 “수면내시경 후 회복되었다고 생각하고 혼자 차를 운전해 집에 왔는데, 나중에 보니 어떻게 왔는지 기억이 안 난다는 경험담을 얘기하는 환자들이 있다.”며, “수면마취 후 절대로 자가 운전해서는 안되며, 보호자가 운전하는 차를 타거나 택시 등 대중교통을 이용하고, 하루 정도는 업무나 운동 등도 쉬는 것이 필요하다.”고 당부했다.
채규한 식약처 마약안전기획관은 “내시경이나 수술·시술을 위해 수면마취를 한 후 당일 운전하지 않는 것은 나 자신뿐만 아니라 타인의 생명까지도 보호하는 길”이라며, “식약처는 앞으로도 의료용 마약류를 안전하게 사용하고 국민 안전을 적극적으로 확보할 수 있도록 필요한 정보를 지속적으로 발굴해 안내하겠다.”고 강조했다.
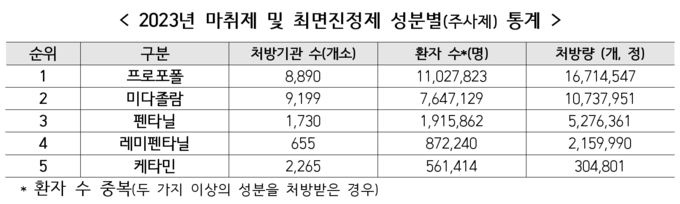
한편 지난해 가장 많은 환자가 처방받은 의료용 마약류의 효능군은 프로포폴 등 성분을 포함하고 있는 ‘마취제’로 ’23년 한 해 동안 1,184만 명이 처방받았으며, 마취를 위해 사용된 상위 5개 성분은 프로포폴, 미다졸람, 펜타닐, 레미펜타닐, 케타민 순이었다.














