질병관리본부(본부장 정은경)는 2019년 11월 15일 발령하였던 인플루엔자 유행주의보를 3월 27일(금) 해제한다고 밝혔다.
인플루엔자 표본감시결과 의사환자(유사증상환자)가 외래환자 1,000명당 제10주(3.1~3.7) 3.9명, 제11주(3.8~3.14) 2.9명, 제12주(3.15~3.21) 3.2명으로 3주 연속 유행기준(5.9명)보다 낮았다.
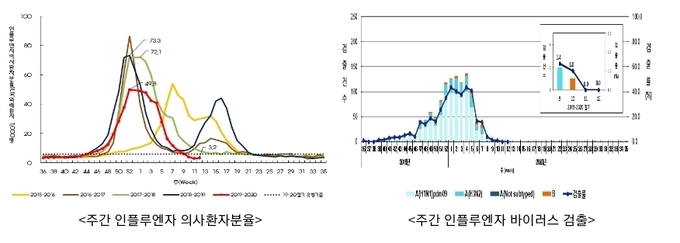
질병관리본부의 유행해제 결정은 의사환자수가 3월 이후 3주 연속 유행기준이하일 경우 인플루엔자 자문위원회의 검토를 거쳐 결정하고 있으며, 3월 25일 자문결과 2019-2020절기 인플루엔자 유행주의보를 3월 27일 해제하기로 결정하였다.
2019-2020절기 인플루엔자는 2018-2019절기와 동일하게 52주차에 정점에 도달하였고, A형 인플루엔자가 주로 유행하였다.
2019-2020절기의 정점은 ‘19년 52주(12.22~12.28) 외래환자 1,000명당 49.8명으로 지난 절기의 정점인 ’18년 52주(12.23~12.29) 73.3명과 시기는 동일하였으나, 의사환자수는 낮게 나타났고 환자의 대부분이 A형(96%이상) 인플루엔자였다.
유행주의보 발령시점(2019.11.15)은 지난절기와 동일하고, 종료 시점(2020.3.27)은 12주 빨라서 이번절기의 유행기간이 짧아졌다.
질병관리본부 정은경 본부장은 “인플루엔자 유행은 해제되었지만 코로나19의 지역사회 감염이 계속되고 있는 상황에 대처하고, 각종 감염병 예방을 위해서 평소 ‘손 씻기, 기침예절 실천 등 개인위생수칙을 준수할 것’을 당부”하였다.
또한, “초·중·고등학교 개학이후 학생들의 집단생활로 인플루엔자 환자 증가 가능성이 있어, 개학이후 인플루엔자 환자 발생추이를 예의 주시하겠다”고 밝혔다.












