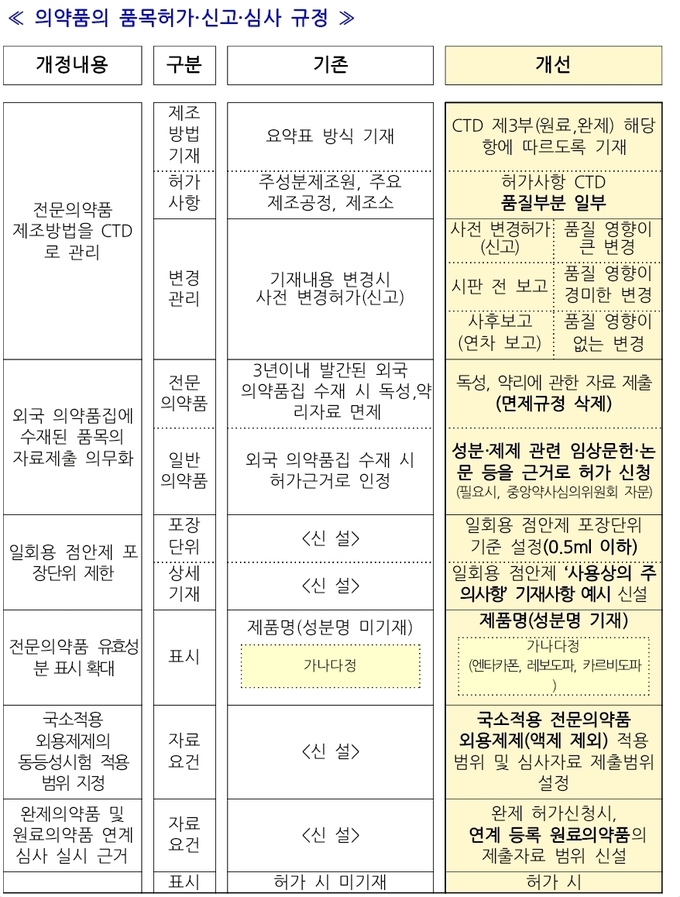
전문의약품 제조공정 등 제조방법 관리가 강화 된다. 개선된 제조방법 등은 1년간의 유예기간을 거쳐 내년 11월12일부터 적용된다. 제약업계의 준비사항 등을 고려한 조치로 풀이된다.
강화되는 관리는 전문의약품 품목 (변경)허가 시 제조공정 등 제조방법을 기재할 때 국제공통기술문서(CTD)에 따라 상세히 기술해야 한다. 현재는 주요 제조공정 위주로 요약 기재했던 것에 비하면 인력 등의 충원이 필요하다는 지적이다.
또한, CTD로 제출된 제품의 제조방법은 품질과 약효 영향을 고려해 3단계(사전변경허가, 시판전보고, 연차보고)로 변경관리해야하며, 외국 의약품집 수재를 근거로 허가 시 일부 제출자료 면제 규정도 삭제(시행: ’22.11.12.) 된다. 이를 적용할 경우 제네릭 전문 의약품 개발도 쉽지 않을 것으로 제약업계는 전망하고 있다.
외국 의약품집에 수재된 경우 독성, 약리에 관한 자료 등 일부 자료 제출이 면제될 수 있었으나, 앞으로는 과학 근거에 기반해 안전성·유효성을 심사 자료 제출이 의무화 된다.
일회용 점안제 포장단위 제한 기준도 신설(시행: ’22.11.12.)됐다.
일회용 점안제의 재사용으로 인한 국민 불안을 해소하고 의약품의 안전 사용 환경을 마련하기 위해 점안제의 1회 사용량을 고려한 포장단위를 0.5ml 이하로 규정했다.
이밖에 복합성분 전문의약품의 제품명에 유효성분 기재(시행: ’22.11.12.)도 의화화 된다.
현재 단일성분 전문의약품인 경우에만 제품명에 유효성분을 함께 표시했으나, 앞으로는 주성분이 3개 이하인 복합제 전문의약품의 제품명에 유효성분을 함께 표시해 정보제공을 확대했다.
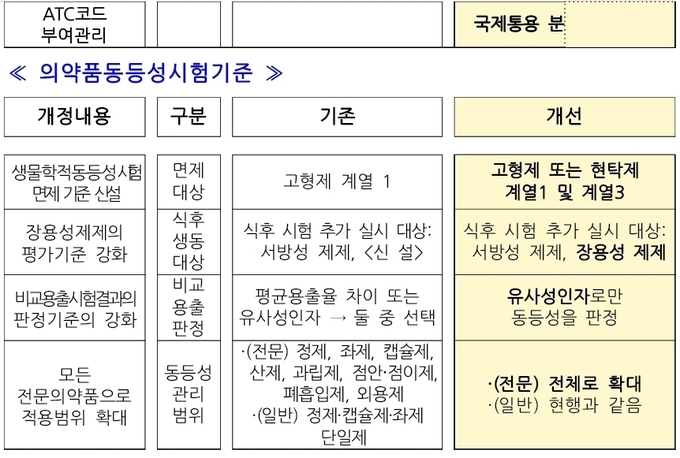
의약품 동등성 시험기준도 일부 개정된다.
제네릭의약품 중 장용성 제제는 장에서 녹아 흡수되도록 만든 제제의 특성을 반영하기 위하여 동등성 평가 시 식후 생동성시험 자료를 제출요건에 추가했다.
또 ICH M9 가이드라인 제정에 따른 계열 3 약물의 생물학적동등성시험 면제 기준을 신설하여 국제기준과 국내 규제의 조화도 모색된다.
식품의약품안전처(처장 김강립)는 이같은 내용을 담아 의약품의 허가심사 기준을 국제기준과 조화시키고 제네릭의약품의 품질신뢰성을 확보하기 위해 「의약품의 품목허가·신고·심사 규정」, 「의약품 동등성 시험기준」을 11월 11일 일부개정 고시·시행했다.














