
한국오노약품공업(대표이사: 양민열)과 한국BMS제약(대표이사: 김진영)은 지난 9월 21일 유럽종양학회 2020 온라인 회의(ESMO Virtual Congress 2020)의 프레지덴셜 심포지엄(Presidential Symposium)에서 절제가 불가능한 진행성 또는 전이성 위암, 위식도접합부암 또는 식도 선암 환자의 1차 치료에서 옵디보-화학요법 병용이 화학 단독요법 대비 전체 생존기간 및 무진행 생존기간에서 통계적으로 유의하고 임상적으로 유의미한 개선을 보인 임상 3상 연구인 CheckMate-649의 주요 결과를 발표했다고 22일 밝혔다. CheckMate-649는 위암 및 식도 선암 환자의 1차 치료에서 면역관문억제제 기반 요법을 평가하는 세계 최대 규모의 무작위 배정 글로벌 임상 3상 연구이다. 이번 연구를 통해 옵디보는 화학요법과의 병용 시 화학 단독요법 대비 위암, 위식도접합부암 또는 식도 선암 환자의 전체 생존기간 및 무진행 생존기간에서 우월함을 보여준 첫 PD-1 억제제가 됐다. 복합양성점수(CPS, combined positive score) 5점 이상인 PD-L1 발현 환자에서도 전체 생존기간과 무진행 생존기간의 연장이 관찰돼 1차 유

동아에스티(대표이사 회장 엄대식)는 레드엔비아(REDNVIA, 대표이사 이훈모)가 당뇨병치료제 슈가논(성분명: 에보글립틴)을 대동맥심장판막석회화증 치료제로 개발하기 위한 미국 임상 2b/3a상 IND 승인을 미 FDA로부터 받았다고 22일 밝혔다. 이번 임상은 2020-2021년 미국 최고의 병원으로 선정된 메이요 클리닉(Mayo Clinic)과 하버드의대 부속병원인 매사추세츠 종합병원(Massachusetts General Hospital) 등에서 참여할 예정이다. 또한, 레드엔비아는 이들 기관 연구진과의 긴밀한 협력 및 미국국립보건원(NIH)으로부터 임상연구 자금을 지원받아 신속한 임상개발을 통해 제품 상용화를 최대한 앞당긴다는 전략이다. 앞서 레드엔비아는 2019년 6월 대동맥심장판막석회화증에 대한 국내 임상2상 IND 승인을 받아 환자 225명을 대상으로 국내 임상 2상을 진행해 왔으며, 올해 7월 미국 FDA에 임상 2b/3a상 IND를 신청했다. 레드엔비아는 동아에스티가 개발한 당뇨병치료제 슈가논의 물질특허와 서울아산병원의 대동맥심장판막석회화증 치료제 용도특허를 기술이전해 설립한 합작법인(Joint Venture)이다. 동아에스티는 지난해 1월 레
㈜헬릭스미스는 유전자치료제 ‘엔젠시스(VM202)’의 샤르코마리투스병(CMT)에 대한 국내 임상 1/2a상에서 첫 환자에 대한 투약을 실시했다. 삼성서울병원 최병옥 신경과 교수팀이 이끄는 임상시험팀은 지난 21일 CMT 임상 환자에 대한 엔젠시스(VM202) 투여를 시작했다. 이번 CMT 임상 1/2a상은 총 12명의 CMT 환자를 대상으로 엔젠시스(VM202)의 안전성과 내약성을 평가한다. 헬릭스미스는 이번 임상을 통해 안전성 및 유효성 데이터를 확보할 계획이다. 국내에서 진행되는 이 임상시험에서 긍정적인 결과가 나오면 회사는 미국과 유럽 등 글로벌 임상시험 실시를 계획하고 있다. CMT병은 운동신경과 감각신경의 점진적인 손상에 의해 팔과 다리의 근육이 위축되고 보행 장애가 발생하는 질환이다. 희귀질환 중에서는 환자 수가 가장 많은 것으로 보고되어 있다. CMT에는 몇가지 종류가 있는데 이번 임상시험의 대상인 CMT1A는 전체 CMT 환자의 약 40%를 차지한다. 국내에는 약 8천명, 전세계적으로 약 120만명 이상의 CMT1A 환자가 있는 것으로 알려져 있다. 이와 같이 많은 환자가 있음에도 불구하고 아직까지도 FDA 승인을 받은 치료약은 없는 상황이다.

임핀지는 동시적 항암화학방사선요법 이후 질병이 진행되지 않은 절제불가 3기 비소세포폐암(NSCLC) 환자에서 치료 4년 시점에서도 지속적이고 임상적으로 유의한 전체 생존(Overall Survival, OS) 및 무진행 생존(Progression-free Survival, PFS) 개선을 나타냈다. 비소세포폐암 환자 3명 중 1명은 3기에 진단되며, 대부분 수술적 절제가 불가능한 상태로 발견된다. , 임핀지가 절제불가 3기 비소세포폐암 치료에 허가를 받기 전까지, 지난 십 수년 간 항암화학방사선요법이 유일한 치료법이었다. PACIFIC 연구의 추적분석 결과, 치료 4년 시점(1년 간의 임핀지 투약 완료 후 3년 시점)에서 나타난 임핀지 치료군의 전체 생존율(OS rate)은 49.6 %으로, 위약군 36.3 %보다 높았다. 임핀지 치료군의 전체생존기간 중간값(median OS)은 47.5 개월로, 위약군 29.1 개월에 비해 길었다. 최대 12개월 동안 임핀지를 투약한 환자의 35.3%가 4년 동안 질병이 진행되지 않았던 반면, 위약군의 무진행 생존율(PFS rate)은 19.5%로 나타났다. PACIFIC 연구의 1차 유효성 평가지표(primary endp

한미약품이 개발한 항암신약 포지오티닙의 글로벌 임상 2상(ZENITH20) 코호트2 연구 결과 및 치료 대안이 없는 응급환자 대상 임상 연구 결과가 유럽종양학회(ESMO) Virtual Congress 2020에서 지난 19일 발표됐다. 한미약품 파트너사 스펙트럼은 코호트2 연구 결과를 바탕으로 FDA에 신약시판허가(NDA)를 위한 미팅 신청을 완료하는 등 포지오티닙의 신속한 허가를 위한 절차를 시작했다. 올해 유럽종양학회는 전세계적 코로나19 여파로 지난 19~21일 온라인으로 진행됐다. 구연으로 발표된 코호트2 연구는 치료 전력이 있는 EGFR/HER2 엑손20 삽입 변이 비소세포폐암 환자 90명을 대상으로 하루 1회 포지오티닙 16mg 경구 투여 방식으로 진행됐다. ITT 분석에서 ORR(객관적반응율)은 27.8%였다. 치료 전력이 있는 환자들의 ORR 최소값 예상치는 17%였으나 실제 ORR 최소값은 18.9%로 유의미한 결과가 확인됐다. DCR(질병조절율)은 70%였으며, 전체 환자의 74%인 67명에서 종양 감소가 확인됐다. 종양 감소 중앙값은 22%였다. 평가 가능한 환자 74명에서 ORR은 35.1%, DCR은 82.4%로 확인됐다. mDOR(
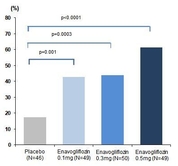
대웅제약(대표 전승호)이 18일부터 19일까지 진행된 ‘2020 ICDM(2020 International Congress of Diabetes and Metabolism)’에서 현재 개발중인 SGLT-2 계열 당뇨병 치료제 ‘이나보글리플로진’의 임상 2상 결과를 최초로 발표했다. 이번 ICDM(국제 당뇨병 및 대사질환 학술대회)은 대한당뇨병학회 주최, 10주년을 맞은 국제학술대회로 신종 코로나바이러스 감염증(코로나19) 확산방지 차원으로 온라인을 통해 진행됐다. 이나보글리플로진은 혈당이 적절히 조절되지 않는 2형 당뇨병 환자를 대상으로 12주 복용했을 때, 투여 4주차부터 위약대비 당화혈색소(HbA1c) 변화량이 통계적으로 유의한 감소를 보였고, 12주 째에는 위약 대비 약 0.9% 감소했다. 이는 통계적으로 유의한 결과로 기존 서양인들을 대상으로 진행됐던 타사 SGLT2 억제제보다 약 0.2~0.3% 정도의 추가적인 당화혈색소 감소이며 추가 연구가 기대되는 결과다. 대상자별 치료효과를 평가한 12주 때는 당화혈색소가 7.0% 이하로 도달한 환자 비율이 최대 61%에 달해 기존 SGLT-2 억제제보다 효과를 보인 환자 비율이 20% 이상 증가한 결과를 보였
㈜헬릭스미스는 미국식품의약국(FDA)에 유전자치료제 ‘엔젠시스(VM202)’의 당뇨병성 신경병증(DPN) 임상 3-3상 프로토콜을 제출했다고 16일 밝혔다. 이번 DPN 임상 3-3상은 엔젠시스(VM202)의 유효성을 확인하기 위한 임상시험으로서, 복수의 3상 임상 결과를 권고하는 미국 FDA 가이드라인에 따라 기획되었다. 그 내용은 지난 3-2상과 거의 같은데, 다만 장기간(1년) 통증 효과와 안전성 데이터를 수집하기 위해 추적 관찰기간을 1년으로 설정했다. 주평가 지표는 첫 주사 후 6개월째에 통증일기(pain diary)로 측정된 지난 1주일 간의 평균 통증의 감소 효과를 측정한다. 부평가 지표는 (1) 6, 9, 12개월째에 지난 1주일 간의 평균 통증의 감소 효과가 50% 이상인 환자의 비율, (2) 첫 주사 후 9, 12개월째에 통증일기로 측정된 지난 1주일 간의 평균 통증의 감소 효과, (3) 6, 9, 12개월째에 가장 심한 통증의 감소 효과 등이다. 대상 환자는 3-2상과 마찬가지로 프리가발린, 가바펜틴 등 가바펜티노이드 계열 약물을 복용하지 않는 DPN 환자다. 환자 규모는 처음에 152명으로 시작해 50%의 피험자에 대한 자료를 수집한 뒤

사노피 젠자임의 ‘듀피젠트®(성분명: 두필루맙, 유전자재조합)’가 만 12세 이상 청소년 및 성인 중등도-중증 천식 환자를 대상으로 한 3년(96주) 장기 임상연구 데이터를 통해 일관된 치료효과와 안전성 프로파일을 확인했다. 해당 데이터는 2020 유럽호흡기학회 연례학술대회(ERS, European Respiratory Society)의 라이브 세션에서 발표되었다. 미국 국립유대의료센터 천식연구원(National Jewish Cohen Family Asthma Institute) 소속 마이클 웩슬러(Michael Wechsler)박사는 “이번 연구를 통해 듀피젠트®가 중등도-중증 천식 환자들이 경험하는 점진적인 폐 기능 감소를 늦추고 최대 3년 동안 지속적으로 폐 기능을 개선하는 것을 확인했다”며, “듀피젠트® 투여군은 천식 증상을 조절에 성공했고, 응급실 내원을 유발할 수 있는 천식 악화 빈도 또한 감소했다”고 설명했다. 특히 “듀피젠트®는 천식 환자, 그 중에서도 제2형 염증성 천식 환자에서의 호흡 능력을 개선시켰다”며, “이는 장기간의 천식 치료에 있어 듀피젠트®의 치료 효과를 확인한 의미 있는 결과”라고 강조했다. 이번 ERS에서 발표될 연구에는 듀피
㈜헬릭스미스가 유전자치료제 ‘엔젠시스(VM202)’의 근위축성 측삭경화증(ALS, 루게릭병) 미국 임상 2상에 대한 임상시험 수탁기관(CRO)으로 Worldwide Clinical Trials(월드와이드)를 선정했다. 헬릭스미스는 최근 월드와이드와 포괄적 협력계약(Master Service Agreement, MSA)을 체결했다. 이번 CRO 계약 체결에 따라 월드와이드는 미국에서 실시할 엔젠시스(VM202)의 ALS 임상 2상을 관리할 예정이다. 월드와이드는 미국에 본사를 두고 60여개 국가에 네트워크를 보유하고 있는 글로벌 기업이다. 중추신경계, 심혈관 및 대사장애, 일반 의학, 종양학 및 희귀질환에 중점을 두고 미충족 의료수요가 큰 질환을 전문으로 한다. 30년 이상의 중추신경계 연구 지원 경험을 보유한 월드와이드는 ALS 임상시험 관리 분야에서 국제적으로 인정받는 전문 CRO다. 대부분의 ALS는 원인을 알 수 없고 질병의 전개를 점수를 매겨 판단하기 때문에 경험이 많은 전문기관이 아니면 임상시험을 관리하기 매우 어렵다. 근위축성 측삭경화증(ALS)은 치명적인 진행성 신경근육 질환으로 루게릭병이라고도 불린다. 근육의 움직임을 조절하는 운동 뉴런(신경세

㈜지엔티파마(대표 곽병주)가 뇌세포 보호 신약 ‘넬로넴다즈’의 임상 3상에 돌입한다. 신약개발 벤처기업 지엔티파마는 중국 파트너인 헹디안 그룹 아펠로아가 뇌세포 보호 신약 ‘넬로넴다즈’의 임상 3상 시험을 중등도 및 중증 급성 뇌졸중 환자를 대상으로 중국 40개 대학병원에서 개시한다고 10일 밝혔다. 넬로넴다즈 임상 3상 시험은 위약(플라시보) 또는 넬로넴다즈를 1:1의 비율에 따라 이중 맹검방식으로 투약하여 위약 대비 넬로넴다즈의 약효와 안전성을 검증하는 연구다. 발병 후 8 시간 이내의 급성 허혈성 뇌졸중 환자 948명을 대상으로 진행한다. 시험에 참여하는 뇌졸중 환자는 CT 영상으로 허혈성 뇌졸중이 확인되고 미국 국립보건원 뇌졸중 등급(NIHSS)에 따라 9-22 사이의 중등도 또는 중증 장애가 있어야 한다. 시험자는 약물을 투여하기 전에 허혈성 뇌졸중의 유일한 치료법인 혈전용해제tPA(tissue plasminogen activators)나 유로키나제를 투여받는다. 이번 임상 3상 시험은 선행 임상 연구에서 확인된 약효와 안전성에 근거하여, 넬로넴다즈 총 6000 mg을 5일에 걸쳐 투여한 후 90±7일까지 뇌졸중 환자의 장애, 사망, 출혈 등을 정량