식품의약품안전처(처장 김강립)는 국내 의약품의 독성시험 기준을 국제 기준과 조화시키고 최신 시험법으로 정비하는 내용을 담아 「의약품등의 독성시험기준」(식약처 고시)을 3월 2일 개정·시행했다.
주요 내용은 ▲면역독성시험법에 최신 국제 공인 시험법 추가 ▲독성시험 대상 동물을 시험 특성과 과학적 근거에 따라 세분화 ▲발암성시험의 시험물질 섭취량 측정 주기 단축 등이다.
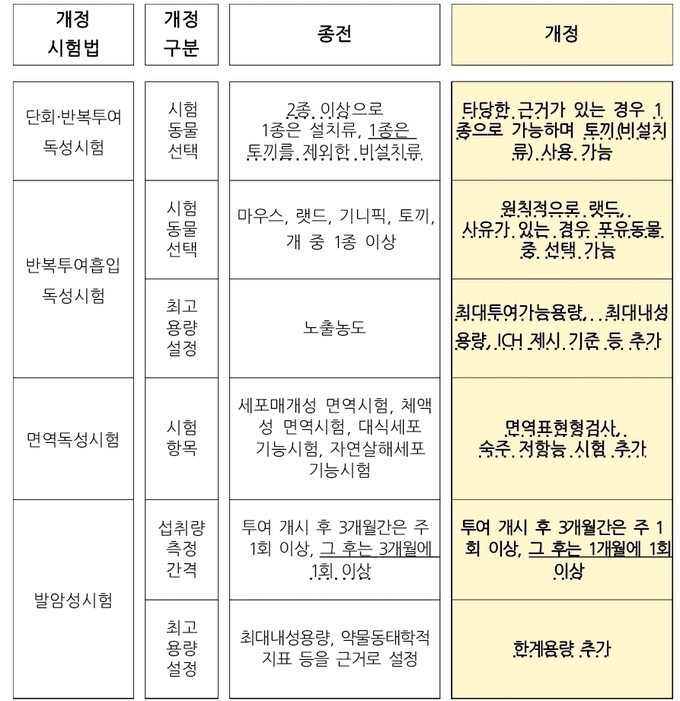
-의약품등의 독성시험기준 주요 개정 내용
면역독성시험법에 최신 국제 공인 시험법 추가
면역독성시험법의 종류에 최신 국제 공인 시험법인 ‘면역 표현형 검사’와 ‘숙주 저항능 시험’을 추가해 시험물질의 특성과 체내 면역반응 종류에 따라 시험법을 선택할 수 있도록 했다.
독성시험 대상 동물을 시험 특성과 과학적 근거에 따라 세분화
종전에는 단회·반복투여독성시험 시 ‘설치류 1종’과 ‘비설치류 1종(토끼류 제외)’을 각각 모두 시험했어야 하나, 앞으로는 타당한 과학적 근거가 있는 경우 토끼류 포함해 시험 동물 1종만을 시험할 수 있도록 했다.
또한 반복투여흡입독성시험 시 5종의 포유동물(마우스, 랫드, 기니픽, 토끼, 개) 중 1종 이상을 선택할 수 있었으나, 앞으로는 원칙적으로 랫드를 사용하도록 하고 타당한 과학적 근거가 있는 경우에만 랫드 대신에 다른 포유동물 1종을 선택할 수 있도록 했다.
발암성시험의 시험물질 섭취량 측정 주기 단축
발암성시험 중 시험물질을 사료·물에 혼합해 투여하는 경우 시험물질 섭취량 측정 주기를 단축했다. 투여 개시부터 3개월까지는 종전과 같이 주 1회 이상 시험물질의 섭취량을 측정하고, 투여 개시 3개월 이후에는 석 달마다 측정하던 것을 한 달로 단축해 측정했다.













